Victor Ambros és Gary Ruvkun kapja az idei orvosi-élettani Nobel-díjat a génszabályozásban döntő szerepet játszó mikro-RNS felfedezéséért – jelentették be hétfőn a stockholmi Karolinska Intézetben.
Az apró RNS-molekulák új osztályát a C. elegans férget vizsgálva fedezték fel a tudósok. A Caenorhabditis elegans a talajférgek rendjébe tartozó, körülbelül 1 milliméter hosszú, talajban élő, átlátszó fonálféregfaj. Ugyan a mikro-RNS-eket ezen állatokat vizsgálva fedezték fel, de jelenlétük és működésük nélkülözhetetlen a többsejtű szervezetek számára, beleértve az embereket is.
A kitüntetettek 11 millió svéd koronán (388 millió forintnyi összeget) osztoznak. A díjat hagyományosan december 10-én, az elismerést alapító Alfred Nobel halálának évfordulóján adják át.
A kromoszómáinkban tárolt információ testünk összes sejtjére vonatkozó használati utasításhoz hasonlítható. Minden sejt ugyanazokat a kromoszómákat tartalmazza, tehát minden sejt pontosan ugyanazt a génkészletet és pontosan ugyanazt az utasításkészletet hordozza. Mégis, a különböző sejttípusok, mint például az izom- és idegsejtek, nagyon eltérő tulajdonságokkal rendelkeznek. Hogyan keletkeznek ezek a különbségek? A válasz a génszabályozásban rejlik, amely lehetővé teszi, hogy minden sejt csak a megfelelő utasításokat válassza ki. Ez biztosítja, hogy minden sejttípusban csak a megfelelő génkészlet legyen aktív – írta a kutatók munkájáról szóló közlemény bevezetőjében a Svéd Királyi Tudományos Akadémia. Az idei orvosi-élettani Nobel-díj egy olyan létfontosságú szabályozó mechanizmus felfedezéséért járt, amely a sejtekben működik a génaktivitás szabályozására.
A genetikai információ a DNS-ből a hírvivő RNS-be (mRNS) áramlik a transzkripciónak nevezett folyamaton keresztül, majd a sejtek fehérjetermelő rendszerébe kerül. Ott az mRNS-eket „kiolvassák”, így a fehérjék a DNS-ben tárolt genetikai utasítások szerint készülnek. A 20. század közepe óta a legalapvetőbb tudományos felfedezések közül több is megmagyarázta ezeknek a folyamatoknak a működését.
Azon túl, hogy a megfelelő gének a megfelelő időben legyenek aktívak, az is fontos, hogy a génaktivitást folyamatosan finomhangolni kell, hogy a sejtfunkciókat a testünkben és a környezetünkben uralkodó változó körülményekhez igazítsuk. Ha a génszabályozás meghibásodik, az olyan súlyos betegségekhez vezethet, mint a rák, a cukorbetegség vagy az autoimmunitás. Ezért a génaktivitás szabályozásának megértése hosszú évtizedek óta fontos cél.
Az 1960-as években kimutatták, hogy a speciális fehérjék, az úgynevezett transzkripciós faktorok, képesek kötődni a DNS meghatározott régióihoz, és szabályozni tudják a genetikai információáramlást azáltal, hogy meghatározzák, mely mRNS-ek keletkezzenek. Azóta több ezer transzkripciós faktort azonosítottak, és sokáig azt hitték, hogy a génszabályozás főbb elveit megismerték. 1993-ban azonban az idei Nobel-díjasok váratlan eredményeket tettek közzé, amelyek a génszabályozás új szintjét írták le, amely rendkívül jelentősnek és az evolúció során konzerváltnak bizonyult.
Az 1980-as évek végén Victor Ambros és Gary Ruvkun posztdoktori ösztöndíjas volt a 2002-ben Nobel-díjjal kitüntetett Robert Horvitz laboratóriumában. Horvitz laboratóriumában egy viszonylag szerény, 1 mm hosszú férget, a C. eleganst vizsgálták. Kis mérete ellenére a C. elegans számos speciális sejttípussal rendelkezik – így például ideg- és izomsejtekkel –, amelyek nagyobb, összetettebb állatokban is megtalálhatók, ezért hasznos modellnek számít a szövetek fejlődésének és érésének vizsgálatára a többsejtű szervezetekben. Ambrost és Ruvkunt főként azok a gének érdekelték, amelyek meghatározták a C. elegans különböző genetikai programjainak időzítését: e gének működése döntötte el, hogy mikor alakultak ki a féreg eltérő működésű sejttípusai.
Két mutáns gént, a lin-4-et és a lin-14-et tanulmányozták, amelyek hibákat mutattak a genetikai programok aktiválásának időzítésében a fejlődés során. Ambros korábban kimutatta, hogy a lin-4 gén a lin-14 gén negatív szabályozója, azonban működése nem volt ismert.
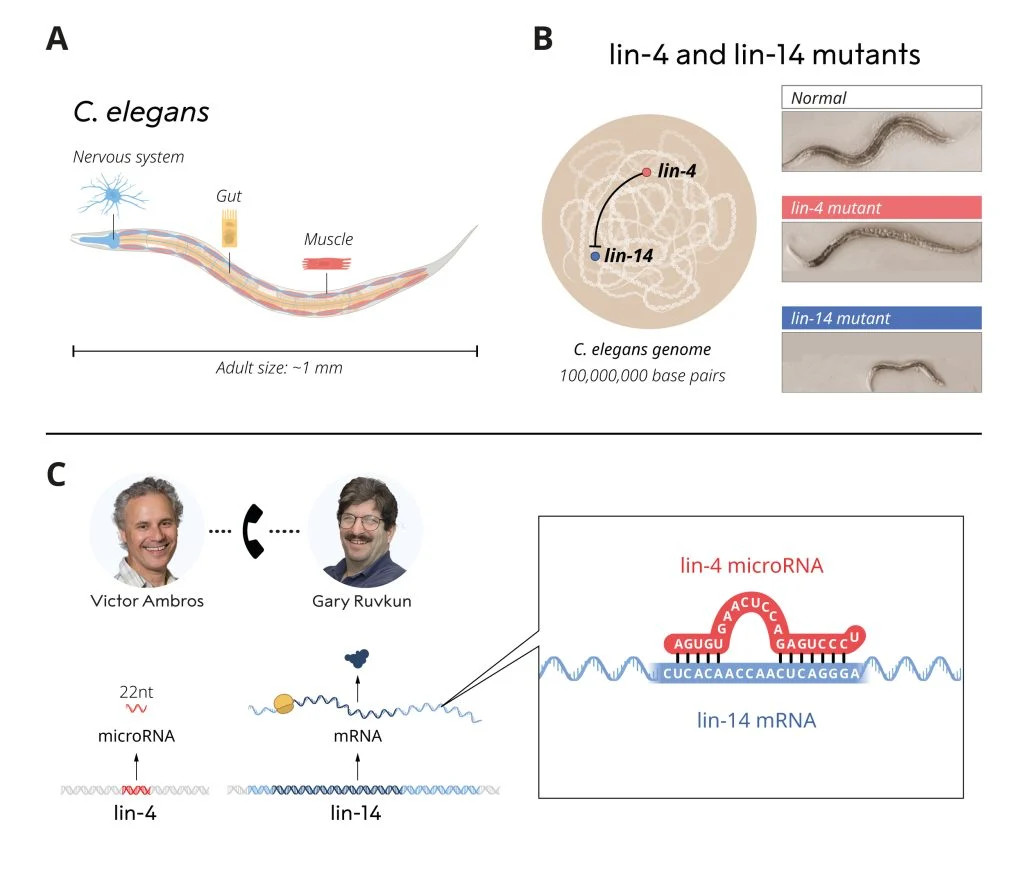
Posztdoktori kutatása után Victor Ambros a Harvard Egyetemen újonnan alapított laboratóriumában elemezte a lin-4 mutánst és felfedezte, hogy ez a gén szokatlanul rövid RNS-molekulát termelt, amelyből hiányzott a fehérjetermelés kódja. Ez a meglepő eredmény arra utalt, hogy a lin-4-ből származó kis RNS felelős a lin-14 gátlásáért.
Később, amikor már a saját kutatócsoportjaikat vezetve kutattak tovább, felismerték, hogy a génműködést szabályozó gének egy szokatlanul rövid RNS-molekulát kódolnak, amelyből hiányzik a fehérjeszintézishez szükséges kód. Magyarul e gén végterméke
a rövid RNS, ami nem mRNS (hírvivő RNS), és nem egy fehérjemolekula létrehozása a célja.
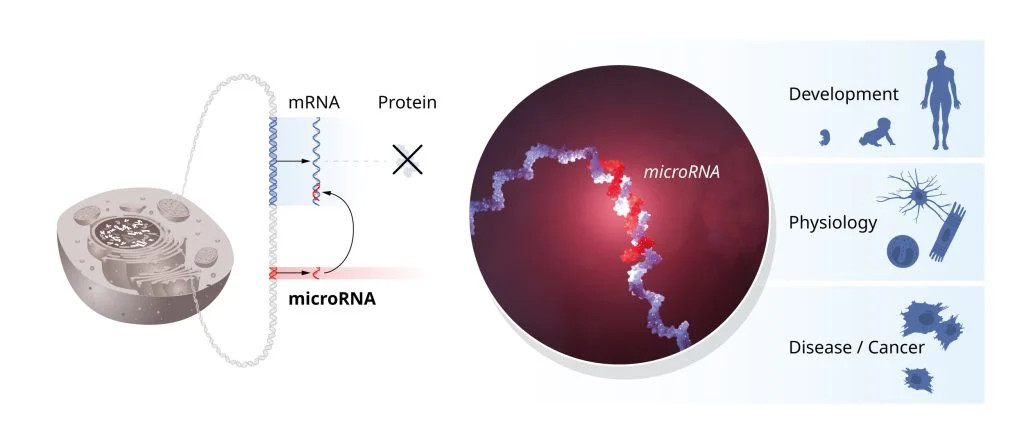
A felfedezést követő vizsgálatok révén feltárták, hogy e mechanizmus a korábban is ismert génszabályozó lépéseknél később hat, így nem a gén RNS-sé történő átírását gátolja, hanem a létrejött RNS-ek blokkolják a fehérjeszintézist. Kiderült ugyanis, hogy az egyik szabályozógén által kódolt mikroRNS kapcsolódik a másik szabályozógén által expresszált, komplementer szekvenciát tartalmazó mRNS-hez, és leállítja a fehérjévé történő átírását. Ezt a merőben új génszabályozó mechanizmust először 1993-ban publikálták a Cell folyóiratban.
Mint a Magyar Tudományos Akadémia összegzett, e felfedezés a következő években nem igazán ragadta meg a tudományos közvélemény érdeklődését, a legtöbben azt gondolták róla, hogy nincs relevanciája a magasabb rendű élőlényekben, és csak a fonálférgekben működik. Ez a helyzet alapvetően megváltozott 2000-ben, amikor Ruvkun kutatócsoportja talált egy másik gént, amelynek a működését ugyancsak mikroRNS szabályozta. Ráadásul ez a gén már nem fonálféreg-specifikus volt, hanem egy erősen konzervált génről volt szó, vagyis szinte változatlan formában jelen volt a legkülönfélébb alacsonyabb és magasabb rendű állatokban.
Ez a felfedezés már szenzációként hatott, rengetegen kezdtek mikroRNS-eket keresni, és alig néhány év alatt több százat felfedeztek közülük.
Ma már jól tudjuk, hogy a mikroRNS-ek útján történő génszabályozás univerzális a soksejtű életformák körében.
A mikroRNS-ek már sok száz millió éve szabályozzák az élőlények génjeinek működését. Ha hiba csúszik a mikroRNS-ek működésébe, az a legkülönfélébb károsodásokat okozhatja a sejtek felépülésében és funkciójában. Ezért a mikroRNS-ek szerepet játszanak például a rák, illetve számos genetikai betegség kialakulásában is.

